Características de gases
La relación entre el volumen y la temperatura del gas fue descubierta por el físico francés Jacques Charles en 1787 y, de manera independiente por Joseph Louis Gay-Lussac, que la publicó en 1802. Sus estudios demostraron que, a una presión constante, el volumen de una muestra de gas se expande cuando se calienta y se contrae al enfriarse.
En 1848, Lord Kelvin comprendió el significado de dicho fenómeno. Identificó la temperatura de -273.15°C como el cero absoluto, teóricamente la temperatura más baja posible. Tomando el cero absoluto como punto de partida estableció entonces una escala de temperatura absoluta, conocida ahora como escala de temperatura Kelvin. En la escala Kelvin, un kelvin ( K ) es igual en magnitud a un grado Celsius. La única diferencia entre la escala de temperatura absoluta y la de Celsius es la posición del cero.
En términos de la escala Kelvin, la ley de Charles se puede expresar como El volumen de una cantidad fija de gas mantenida a presión constante es directamente proporcional a su temperatura absoluta. Así, la duplicación de la temperatura absoluta, digamos de 200 K a 400 K, hace que el volumen del gas aumente al doble.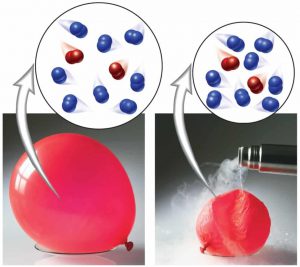
No hay comentarios:
Publicar un comentario